Resumo teórico
Estação de tratamento de esgoto (ETE)

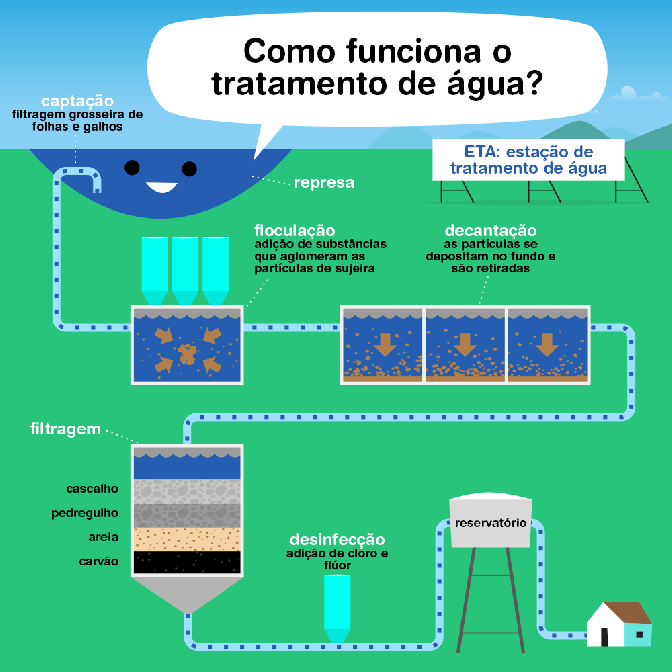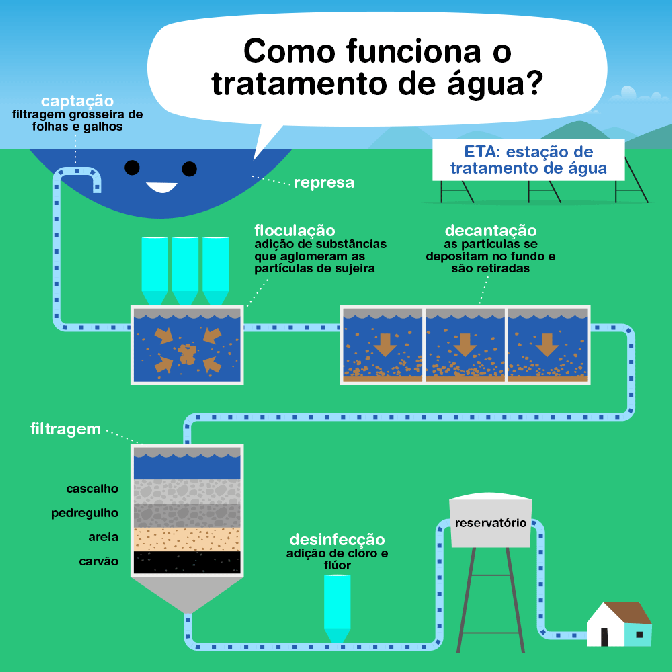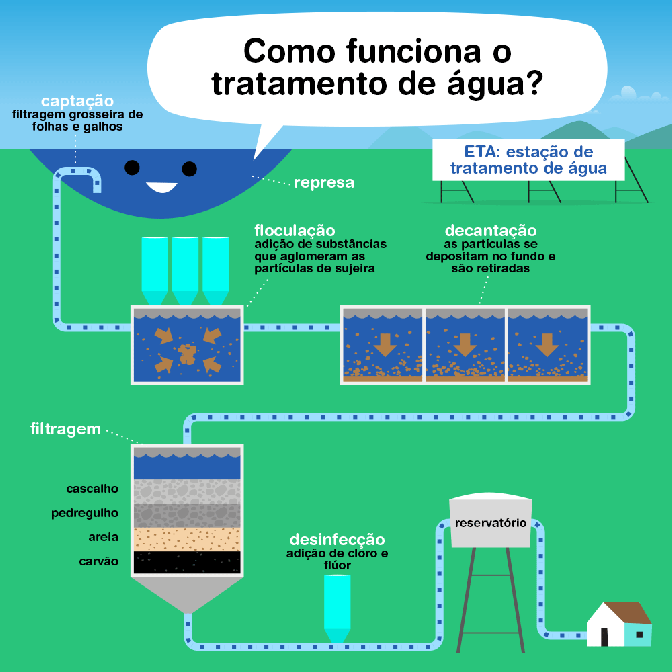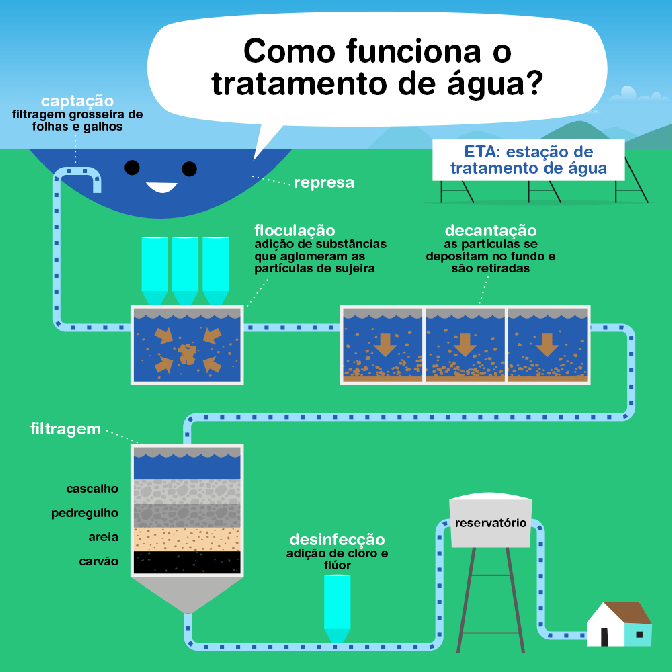
O tratamento de esgoto é um processo fundamental para proteger a saúde pública e o meio ambiente, reduzindo a poluição e permitindo a reciclagem da água. O processo é dividido em várias fases, cada uma com objetivos específicos:
- Fase Preliminar: Esta fase é responsável pela remoção de materiais grosseiros que podem ser facilmente capturados, como lixo, areia, gordura e óleo, que podem danificar ou obstruir os equipamentos das fases subsequentes do tratamento. Utiliza-se de grades, caixas de areia e decantadores de gordura para essa separação.
- Tratamento Primário: O objetivo desta fase é remover os sólidos sedimentáveis e parte da matéria orgânica em suspensão por meio de processos físicos. A principal técnica utilizada é a sedimentação, onde o esgoto é armazenado em grandes tanques, permitindo que os sólidos mais pesados se depositem no fundo, formando o lodo primário, que posteriormente é removido e tratado separadamente.
- Tratamento Secundário: Esta fase foca na remoção substancial da matéria orgânica biodegradável e dos sólidos em suspensão restantes. O tratamento secundário é principalmente biológico, envolvendo micro-organismos em processos como lagoas de estabilização, filtros biológicos ou sistemas de lodos ativados. Os micro-organismos consomem a matéria orgânica como alimento, convertendo-a em massa celular, gás carbônico, água e outros produtos finais.
- Tratamento Terciário ou Avançado: Esta fase é opcional e depende das exigências de qualidade da água de descarga ou da reutilização prevista. O tratamento terciário pode incluir processos físicos, químicos e biológicos para remover nutrientes (como nitrogênio e fósforo), patógenos, metais pesados e compostos orgânicos refratários. Técnicas comuns incluem filtração, adsorção em carvão ativado, troca iônica, osmose reversa e desinfecção (geralmente com cloro ou luz ultravioleta).
Objetivos do Tratamento de Esgoto:

- Proteção da Saúde Pública: Evitar a disseminação de doenças veiculadas pela água, eliminando patógenos presentes no esgoto.
- Proteção Ambiental: Reduzir a poluição em corpos d’água, prevenindo a eutrofização e protegendo a vida aquática.
- Reciclagem de Recursos: Recuperar recursos valiosos, como água, energia e nutrientes, para reutilização.
- Cumprimento de Normas Legais: Atender aos padrões regulatórios para descarga de efluentes e gerenciamento de resíduos sólidos.
Cada fase do tratamento de esgoto é projetada para reduzir progressivamente a carga poluidora, garantindo que a água tratada possa ser devolvida ao meio ambiente ou reutilizada de forma segura.