Tabela Periódica
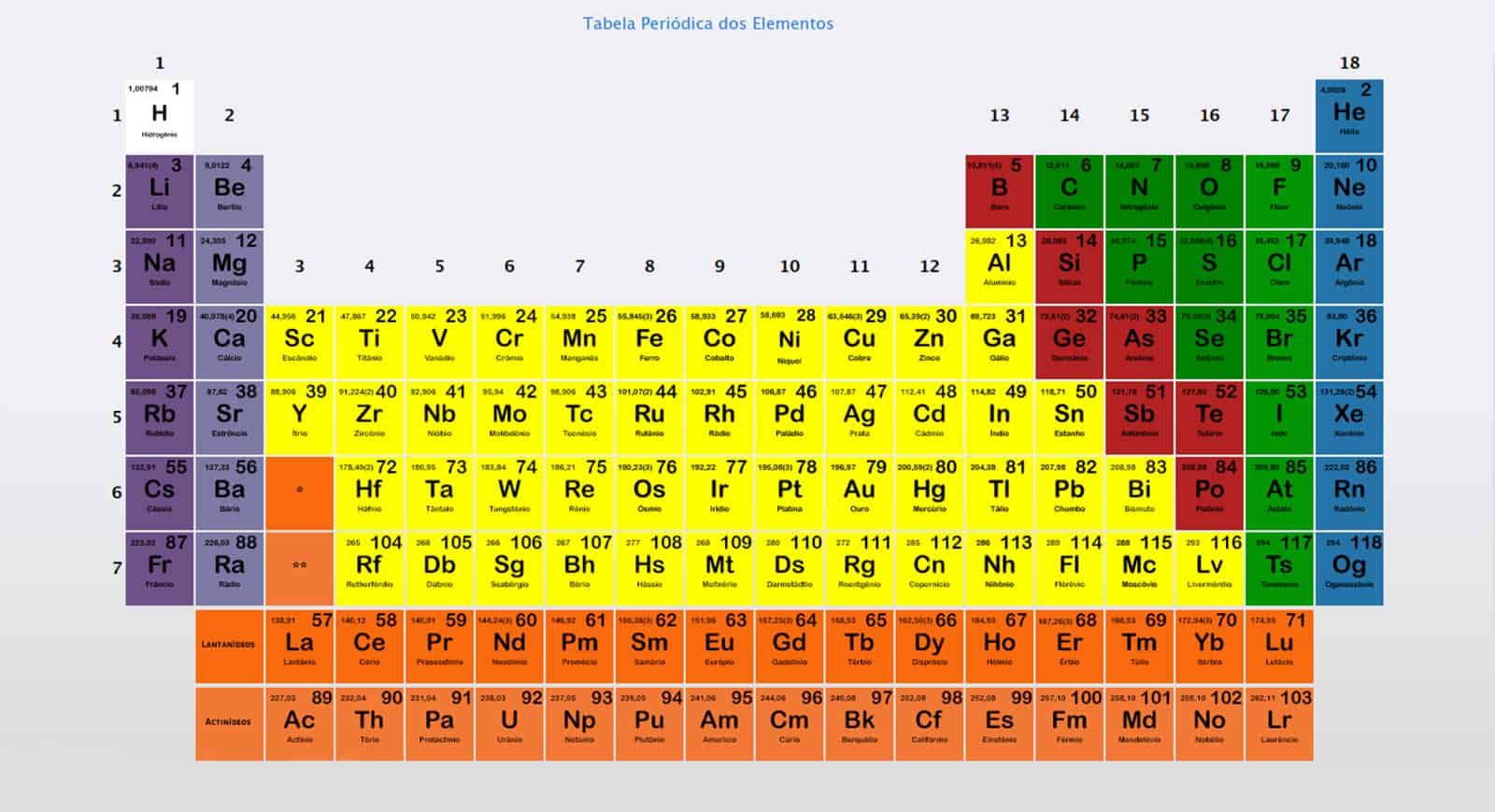
A Tabela Periódica dos Elementos é um dos marcos fundamentais na química, proporcionando um quadro abrangente e sistemático para classificar os elementos químicos. O seu desenvolvimento tem sido um processo contínuo ao longo de muitos anos, com contribuições significativas de vários cientistas.
Breve Histórico

O precursor da tabela periódica moderna foi Dmitri Mendeleev, um químico russo que, em 1869, propôs uma tabela para os 63 elementos conhecidos na época, organizando-os com base nas suas propriedades químicas e em ordem crescente de massa atômica. A genialidade de Mendeleev foi reconhecida pela sua capacidade de prever a existência e as propriedades de elementos que ainda não haviam sido descobertos, como o gálio e o germânio, cujas descobertas subsequentes forneceram uma forte validação do seu trabalho.
Organização Atual
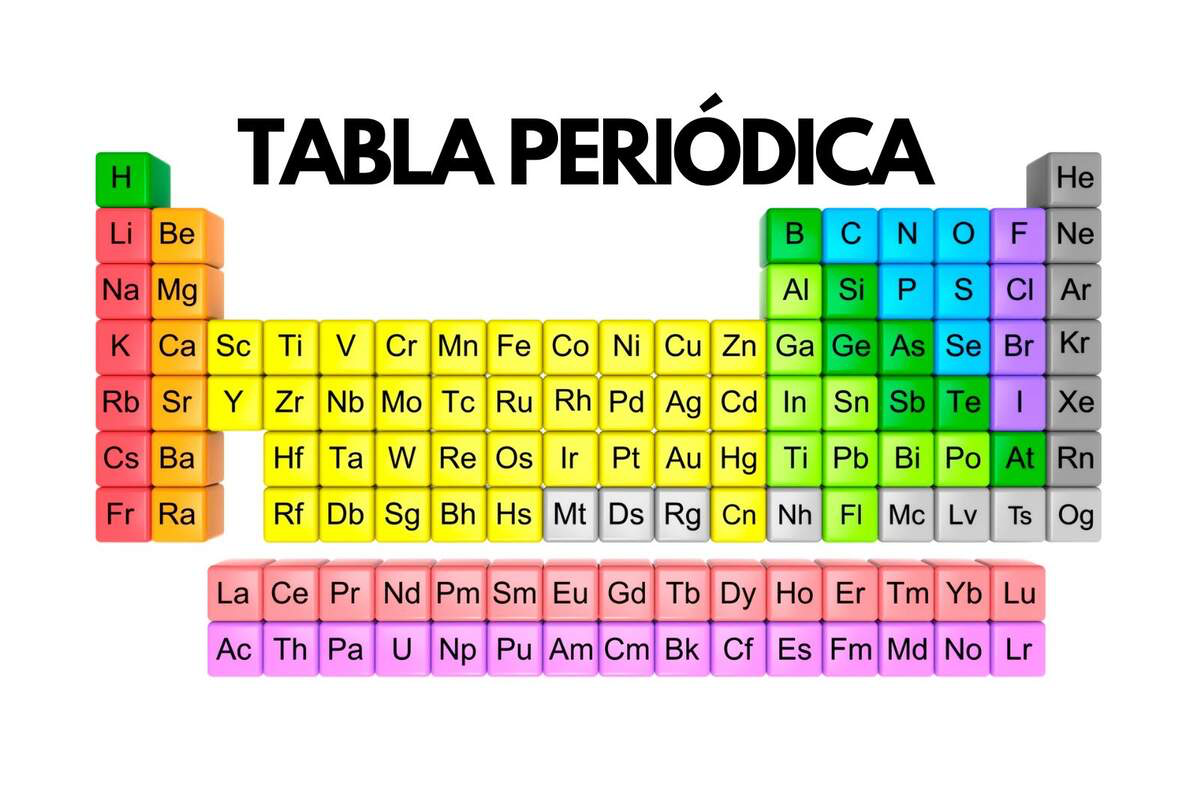
A tabela periódica moderna é organizada em ordem crescente de número atômico (número de prótons no núcleo de um átomo) e não mais pela massa atômica, como na época de Mendeleev. Ela é composta por 18 grupos (colunas verticais) e 7 períodos (linhas horizontais). Os elementos são dispostos de tal maneira que aqueles com propriedades químicas semelhantes caem na mesma coluna, refletindo a periodicidade das propriedades dos elementos à medida que o número atômico aumenta.
Principais Classificações dos Elementos
Os elementos na tabela periódica são comumente classificados em várias categorias, incluindo:
- Metais, Metaloides e Não Metais: Os metais são encontrados na parte esquerda e no centro da tabela e são caracterizados por serem bons condutores de eletricidade e calor, serem maleáveis e terem um brilho característico. Os não metais, localizados principalmente no lado direito da tabela, tendem a ser maus condutores e possuem uma diversidade maior de propriedades físicas. Entre os metais e os não metais, encontram-se os metaloides, que possuem propriedades intermediárias.
- Metais Alcalinos e Alcalino-Terrosos: Os metais alcalinos (grupo 1, excluindo o hidrogênio) são conhecidos por serem muito reativos, especialmente em contato com a água. Os alcalino-terrosos (grupo 2) também são bastante reativos, embora menos que os alcalinos.
- Halogênios e Gases Nobres: Os halogênios (grupo 17) são muito reativos e formam compostos, principalmente com metais, conhecidos como sais. Os gases nobres (grupo 18) são notáveis por sua reatividade extremamente baixa, devido à sua configuração eletrônica estável.
- Elementos de Transição: Localizados nos grupos do 3 ao 12, esses elementos são metais com propriedades magnéticas, catalíticas e de formação de ligas, tendo um papel importante em várias aplicações industriais.
- Lantanídeos e Actinídeos: São séries de elementos que estão localizadas abaixo da tabela principal. Os lantanídeos são conhecidos por suas propriedades magnéticas e luminosas, enquanto os actinídeos são todos radioativos, e muitos são sintéticos.
A tabela periódica continua a ser um campo ativo de pesquisa científica, com novos elementos sendo sintetizados em laboratórios e adicionados à tabela periodicamente, expandindo ainda mais nosso entendimento do mundo atômico e molecular.
